分子的极性
【定义】由分子中正、负电荷重心是否重合,会引起分子有、无极性的现象。
【说明】
1. 当整个分子中正、负电荷重心不相重合时,就形成两个“极”。这正、负两极叫做偶极。这样的分子是有极性的。如果正、负电荷重心相重合,这样的分子没有极性。
2.分子极性的强弱可用分子偶极矩μ来度量。分子的偶极矩越大,分子的极性越大。
3.由同种原子组成的双原子分子没有极性,μ=0。
由典型的金属和典型的非金属组成的气态离子型分子,正、负电荷的重心的分离程度就足够大,这是极性分子的一种极端情况。
由不同原子组成的共价型双原子分子都有极性,μ≠0。分子极性的大小随两元素电负性差的减小而减小。例如,从HF到HI,μ不断减小。
在多原子分子中,如果各个键的偶极矩矢量和为0,分子没有极性,例如CO2是直线形分子(O=C=O),分子中两个C=O极性键对称地分布在碳原子的两边,两个键的极性互相抵消,CO2是非极性分子。三氟化硼分子为平面正三角形,甲烷分子是正四面体结构,这些分子由于结构对称,键的极性互相抵消,正、负电荷重心重合,均为非极性分子。
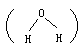
又如水分子是V形分子,两个H—O极性键偏向分子的一端,整个分子正、负电荷重心不重合,是极性分子。氨分子呈三角锥形,也是极性分子。
4. 由于分子有无极性和极性大小都会影响分子间的作用力,因而分子的极性也是决定物质熔点、沸点、溶解性以及分子的电、磁性质的重要因素。
分子的极性会影响物质的性质如溶解性,极性分子易溶于极性溶剂,非极性分子易溶于非极性有机溶剂。例如,NH3、HCl极易溶于水,难溶于有机溶剂。而Br2、I2难溶于水,易溶于CCl4,苯、汽油等。根据物质在不同溶剂中具有不同的溶解性,可用液-液萃取分离的方法分离提纯物质。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。