乙炔
【乙炔的结构】
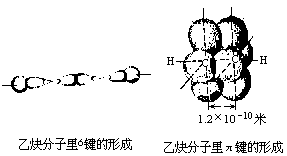
乙炔分子里碳碳叁键的键能是812千焦/摩,比三个碳碳单键的键能之和要小得多(也比一个单键和一个双键键能之和小)。叁键的键长是1.20×10-10米,比单键或双键的键长都短。乙炔分子里C≡C键跟C——H键间的夹角是180°,即乙炔分子里的两个碳原子和两个氢原子处在一条直线上。乙炔分子里每个碳原子,是以一个2s轨道和一个2p轨道进行杂化,形成两个能量相等的sp杂化轨道。这两个sp杂化轨道的对称轴在同一条直线上。每个碳原子各以一个sp杂化轨道跟氢原子的一个1s轨道进行重叠而形成一个碳氢的σ键。同时又各以其另一个sp杂化轨道相互重叠形成一个碳碳的σ键。在两个碳原子里还各有另外两个p轨道没有参加杂化,它们的电子云互相垂直,同时也跟碳碳间σ键的对称轴垂直。这样就在4个p电子之间形成两个π键,这两个π键是互相垂直的。乙炔分子里的C≡C叁键是由一个σ键和两个相互垂直的π键所组成。已知π键的键能小于σ的键能,所以在一定条件下,π键容易断裂,容易发生氧化反应、加成反应等。
【乙炔的化学性质】
乙炔和其它类烃相比,稳定性较差,易分解成碳和氢。乙炔分子分解时放出大量热,其热量足以使乙炔发生连锁反应,故乙炔在加压、加热时可能发生爆炸。某些金属及其氧化物对乙炔的分解有明显催化作用,而且氧化物远比纯金属剧烈。乙炔与金属铜接触产生高爆炸性的乙炔钢。在过热或撞击下,少量乙炔铜爆炸会迅速引起大量乙炔发生爆炸,故在生产乙炔和乙炔加工装置中,通常不允许使用铜和铜合金材料制造管道、阀门等。乙炔燃烧时,火焰明亮有浓厚黑烟。乙炔与空气能形成爆炸混合物,其爆炸范围较其它可燃气体都大。乙炔与氯气混合,在光照下即发生爆炸。乙炔的性质活泼,容易跟许多物质发生化学反应,如受酸性KMnO4溶液氧化,容易发生加成反应(Br2、H2、HCl等)和加聚反应等。
【乙炔的用途】
乙炔的化学性质很活泼,可跟许多物出发生化学反应,衍生出上千种有机化学品。如与氯化氢发生加成反应生成氯乙烯,氯乙烯作为单体经加聚反应得到聚氯乙烯;乙炔跟乙酸反应得到乙酸乙烯酯,可进一步制得维尼纶;乙炔二聚得乙烯基乙炔,进而跟氯化氢加成得氯丁二烯,氯丁二烯经加聚反应制得氯丁橡胶;乙炔跟氰化氢加成得丙烯腈,丙烯腈经加聚反应制得聚丙烯腈等。乙炔在纯氧气中燃烧所产生的温度很高,用于气焊和气割。
【乙炔的实验室制法】
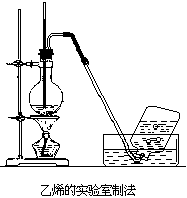
实验室中常用电石跟水反应制取乙炔。电石中因含有少量钙的硫化物和磷化物,致使生成的乙炔中因混有硫化氢、磷化氢等而呈难闻的气味。在常温下,电石跟水的反应是相当激烈的,可用分液漏斗控制加水量以调节出气速度。也可以用饱和食盐水代替水,这样,可以使反应较平稳。通常,乙炔发生装置用烧瓶(或广口瓶)和插有分液漏斗及直角导气管的双孔塞组成。检查装置的气密性良好后把几块电石放入烧瓶,从分液漏斗滴水(或饱和食盐水)即产生乙炔。如果把电石跟水的反应式写成:
CaC2+H2O→C2H2↑+CaO
是错误的。因为在有水存在的情况下,CaO不可能是钙的最终产物,而Ca(OH)2(CaO水化)是最终产物才是合理的。正确的化学式应是:
CaC2+2H2O→C2H2↑+Ca(OH)2
为了得到较纯净的乙炔,可以把从发生器出来的气体先经CuSO4溶液洗气再收集。乙炔只微溶于水,应排水收集。用电石跟水反应制乙炔不应使用启普发生器,块状电石和水在常温下即能发生反应,表面上似乎符合启普发生器的使用条件,但当关闭启普发生器的活塞时,乙炔气虽能把水压入球形漏斗以使电石跟水脱离接触,但集存在球体内的大量水蒸气(电石跟水反应放热)却仍在缓缓继续跟电石发生反应,就是说,关闭活塞后,乙炔不能完全停止发生。这样,乙炔将缓缓从球形漏斗的上口间断逸出。平时,我们总能闻到电石有难闻的气味,就是因为电石跟空气里的水蒸气反应的结果。如果小量制取乙炔时,也可以用试管配单孔塞作反应容器,但应在试管口内松松塞一团棉花,以阻止泡沫进入导气管。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
