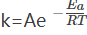活化能
【活化能】活化能是化学动力学中的一种重要概念,1889年由瑞典物理化学家阿累尼乌斯(Arrhenius)首先提出。阿累尼乌斯总结了大量的实验数据,提出了经验公式
式中K为速度常数,A为一常数通常称为“指前因子”或“频率因子”,R为气体常数,T为热力学温度,而Ea即为活化能。活化能的意义是:活化分子的平均能量与反应物分子平均能量之差。
在过渡状态理论中,活化能(能垒)是指反应物分子和活化络合物分子处于基态时的位能差,它不等于Ea。
【定义】
1.对元反应来说,阿伦尼乌斯公式中的活化能(Ea)是活化分子的平均能量跟所有分子的平均能量的差。
2.碰撞理论认为,分子碰撞的剧烈程度不取决于A、B两个分子的总移动能,而取决于它们在质心连线方向上的相对移动能。 只有这个能量超过某一数值(叫临界能)时反应才能发生,碰撞理论就把临界能×NA=Ec做反应活化能(NA是阿佛加德罗常数)。
【说明】
1. 关于活化能定义目前还没有完全统一的提法,随着反应速 率理论的发展,人们对这概念的理解在不断深化。
2. 反应活化能的大小由反应物分子性质所决定,也就跟分子的内部结构密切相关。
3. 不同反应有不同的活化能(Ea),Ea越低,反应进行得越快。在通常反应温度下,大多数反应的活化能在40〜400kJ/mol 范围内。一般的中和反应Ea<40kJ/mol,所以中和反应速率很大,用通常的方法难以测定。
4. 活化能的实验测定常用阿伦尼乌斯公式的不定积分形式求得
lnk=—Ea/RT+B ,
只要测得几个不同温度下的反应速率常数k,以lnk对1/T作图,得到一条直线,由它的斜率一Ea/R就可求得活化能Ea=-(斜率)×R(R是气体常数)。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。