活化分子
【定义】反应中能量较高的、能发生有效碰撞的分子,叫做活化分子。
【说明】
1. 不是反应物分子之间的任何一次直接作用都能发生反应, 只有那些能量相当高的分子之间的直接作用才能发生反应。在一 定温度下,某反应具有的活化分子数由该反应的活化能Ea决定。 根据玻耳兹曼能量分布定律可知,能量大于Ea的分子占总分子数中的分数可用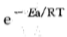 估算。例如,在25°C发生的某反应,活化能Ea是83. 68kJ/mol,则
估算。例如,在25°C发生的某反应,活化能Ea是83. 68kJ/mol,则 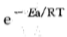 = 2. 15 × 10 一15 = Ni/N 这就是说,在4. 65×1014(=l/2.15×10—15)个分子中只有一个是活化分子。
= 2. 15 × 10 一15 = Ni/N 这就是说,在4. 65×1014(=l/2.15×10—15)个分子中只有一个是活化分子。
2. 活化分子数(或浓度)是决定化学反应速率的重要因素。 对某一给定的化学反应,当温度(T)升高时,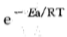 的值增大,活化分子所占的比例增大,反应速率也就增大。
的值增大,活化分子所占的比例增大,反应速率也就增大。
3. 使用催化剂能,低反应活化能,使得具有平均能量的反应物分子只要吸收较少的能量就能变成活化分子,有利于增大化学反应速率。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
