催化剂
【催化剂】能改变化学反应速度而在反应前后本身的化学组成、化学性质及数量没有变化的物质称为催化剂。正催化剂能加快反应速度,负催化剂(阻化剂)能减慢反应速度。
【催化剂的选择性】催化剂的选择性有两方面的含义:
(1)不同类型的反应需要选择不同的催化剂;即便是同一类型的反应,使用的催化剂也不一定相同,如SO2的氧化用的是V2O5催化剂,而乙烯氧化却用金属Ag催化剂。
(2)对相同的反应物,如果选用不同的催化剂,可以得到不同的产物,例如乙醇的分解:
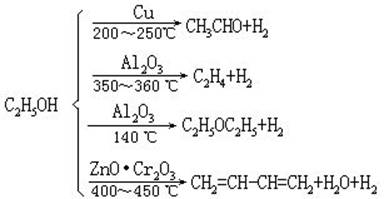
从热力学观点分析,以上的反应都能自发地进行,某种催化剂只对某一特定反应有催化作用,并不能加速所有可能发生的反应。
【催化剂中毒】反应体系中含有少量杂质就能严重降低甚至完全破坏催化剂的活性,这种物质称为催化剂毒物,这种现象称为催化剂中毒。催化剂中毒现象有两类:
(1)暂时性中毒(或称可逆性毒化),如合成氨生产中的O2、H2O(气)、CO、CO2等杂质引起的中毒。只要不断用纯净的原料气吹过中毒的催化剂表面,就可使毒物除去。
(2)永久性中毒(或称不可逆毒化),如合成氨生产中的含硫化合物及PH3等属于永久毒物。这主要是因为这类毒物与催化剂表面形成了牢固的表面化合物。
【定义】能改变化学反应速率而它本身的化学组成和质量在反应前后保持不变,这种物质叫做催化剂。催化剂在反应中所起的作用叫催化作用。
【说明】
1.催化剂能增大或减小化学反应的速率。能增大反应速率的叫正催化剂,例如,接触法制造硫酸使用V2O5,合成氨工业中使用铁触媒等。减小反应速率的叫负催化剂(或叫抑制剂),例如橡胶、塑料制品中的防老剂。食用油脂里加入没食子酸正丙酯,能防止酸败,这是负催化剂的一个例。
2. 催化剂只能改变反应的速率,不能使原来不能发生的反应得以进行。在可逆反应中催化剂只能缩短反应达到平衡的时间, 而不能使化学平衡发生移动。
3. 催化剂一般有选择性,不同的化学反应要选用不同的催化剂。同样的反应物选用不同的催化剂,可以发生不同的反应,从而得到不同的产物。
4. 催化剂有一定的活化温度,在这个温度范围内使用,催化剂的活性最高。
5. 使用催化剂能增大反应速率的机理主要是形成中间产物, 或在催化剂表面的活性中心发生反应,从而改变反应的途径,使反应活化能降低。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
