联氨
【概述】
别名肼,化学式NH2—NH2。无色油状液体,与水、乙醇互溶。熔点2℃,沸点113.5℃,有氨的气味,剧毒。联氨可看做是氨分子内的一个氢原子被氨基取代的衍生物。有碱性,可与无机酸反应生成盐。在水溶液中既显氧化性又显还原性。在酸性溶液中是强氧化剂。在强碱性溶液中是强还原剂。有强腐蚀性,可腐蚀玻璃、橡胶、软木等。有可燃性:N2H4(液)+O2(气)=N2(气)+2H2O(液);ΔH=-624千焦/摩尔 ,用作火箭燃料,医药原料,也常用作还原剂、显影剂。
【结构】
【性质】
1、纯联氨是一种可燃性的液体,它在空气中发烟,能与水及酒精无限混合。在加热时联氨便发生爆炸性的分解。它在空气中燃烧放出大量的热。 它的烷基衍生物可作为火箭的燃料。
N2H4(l) + O2(g) =(加热) N2(g) + 2H2O(1) △rHθ=-624 kJ·mol-1
2、 联氨可以接受两个质子而显碱性,是二元弱碱,碱性稍弱于氨。
N2H4 + H2O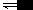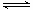 N2H5+ + OH- K1=1.0×10-6(298K)
N2H5+ + OH- K1=1.0×10-6(298K)
N2H5+ + H2O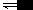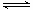 N2H62+ + OH- K2=9.0×10-16(298K)
N2H62+ + OH- K2=9.0×10-16(298K)
它生成的两类盐中,一价酸根的盐如N2H5Cl较稳定,而N2H62+离子所生成的盐均易水解.
3、联氨是一种强还原剂,在碱性溶液中能将CuO、IO3-、Cl2、Br2等还原,本身被氧化为N2。
4CuO + N2H4 = 2Cu2O + N2 + 2H2O
2IO3- + 3N2H4 = 2I- + 3N2 + 6H2O
随着参加反应的氧化剂不同,N2H4的氧化产物除了N2,还有NH4+和HN3。
2MnO4- + 10N2H5+ + 6H+ = 10NH4+ + 5N2 + 2Mn2+ + 8H2O
N2H5+ + HNO2 = HN3 + H+ + 2H2O
N2H4(l) + O2(g) =(加热) N2(g) + 2H2O(1) △rHθ=-624 kJ·mol-1
2、 联氨可以接受两个质子而显碱性,是二元弱碱,碱性稍弱于氨。
N2H4 + H2O
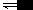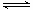 N2H5+ + OH- K1=1.0×10-6(298K)
N2H5+ + OH- K1=1.0×10-6(298K)N2H5+ + H2O
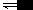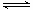 N2H62+ + OH- K2=9.0×10-16(298K)
N2H62+ + OH- K2=9.0×10-16(298K)它生成的两类盐中,一价酸根的盐如N2H5Cl较稳定,而N2H62+离子所生成的盐均易水解.
3、联氨是一种强还原剂,在碱性溶液中能将CuO、IO3-、Cl2、Br2等还原,本身被氧化为N2。
4CuO + N2H4 = 2Cu2O + N2 + 2H2O
2IO3- + 3N2H4 = 2I- + 3N2 + 6H2O
随着参加反应的氧化剂不同,N2H4的氧化产物除了N2,还有NH4+和HN3。
2MnO4- + 10N2H5+ + 6H+ = 10NH4+ + 5N2 + 2Mn2+ + 8H2O
N2H5+ + HNO2 = HN3 + H+ + 2H2O
【制取】
先用氯跟稀氨水反应制得氯氨NH2Cl,然后加过量氨即得联氨。
2NH3+Cl=NH2Cl 2NH3+NH2Cl=N2H4+NH4Cl


