σ键
【概述】两个原子轨道沿键轴方向重叠而形成的一种以两个原子核之间的直线为对称轴的共价键叫σ键。构成σ键的电子叫σ电子。σ键是原子轨道沿轴向重叠的, 具有较大的重叠程度, 因而比较稳定。σ键可以自由旋转, 而不影响电子云的分布。
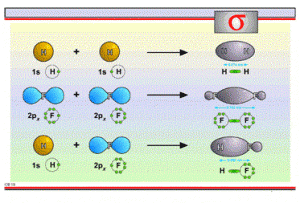
【定义】由两个相同或不相同的原子轨道沿轨道对称轴方向相互重叠而形成的共价键,叫做σ键。下面是它的形成示意图。
 |
| σ键 |
【说明】
1. σ键是原子轨道沿轴方向重叠而形成的,具有较大的重叠程度,因此σ键比较稳定。σ键是能围绕对称轴旋转,而不影响键的强度以及键跟键之间的角度(键角)。
2. 根据分子轨道理论,两个原子轨道充分接近后,能通过原子轨道的线性组合,形成两个分子轨道。其中,能量低于原来原子轨道的分子轨道叫成键轨道, 能量高于原来原子轨道的分子轨道叫反键轨道。以核间轴为对称轴的成键轨道叫σ轨道, 相应的键叫σ键。以核间轴为对称轴的反键轨道叫σ* 轨道, 相应的键叫σ* 键。分子在基态时,构成化学键的电子通常处在成键轨道中,而让反键轨道空着。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
