能斯特方程式
【定义】
它是表达电极电势跟浓度的关系式。氧化还原电对的电极电势是半反应式中各物质浓度(或气体的压强)的函数。设电对〔氧化型〕/〔还原型〕的半反应式是氧化型+ ne=还原型,则该电对的电极电势跟浓度的关系是
E氧化型/还原型 ==Eφ氧化型/还原型十 0.059/n ×lg([氧化型〕÷〔还原型〕
式中E是该电对在非标准态的电极电势,Eφ是标准电极电势,n 是半反应中得失电子数。这就是能斯特方程式。
【说明】
1、
在半反应中,如果还有其他物质参与,则其浓度也应写在方程 式中(固体和水除外)。如果该物质在半反应中处在氧化型一方, 就写在方程分式部分的分子中;如果处在还原型一方,就写在分母中。例如写成Mn04- /Mn02电对。
在酸性溶液中,MnO4- + 4H+ + 3e  Mn02(S) +2H20
Mn02(S) +2H20
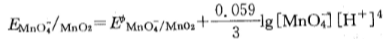
在碱性溶液中,MnO4- + H20 + 3e
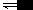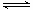 MnO2(S) +40H-
MnO2(S) +40H-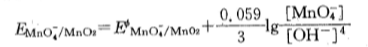
这里两个标准电极电势是不同的,在酸性溶液中E=1. 695V,而碱性溶液中E=0.588V。
对气态物质,用压强写入方程中。例如2H+ + 2e
 H2 ,
H2 ,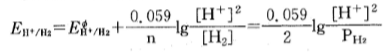
利用奈斯特方程,可以由改变物质的浓度(或气体压强)的方法来改变电对的电极电势,从而有可能改变氧化还原反应的方向。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
