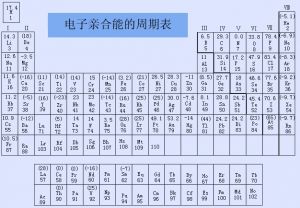
电子亲合能
【定义】指基态的气态原子、离子或分子得到一个电子所释放的能量。元素的电子亲合能指元素的气态原子得到一个电子变为气态-1价阴离子所释放的能量。从电子亲合能数据可以判断元素的原子得电子的难易。非金属元素一般具有比较大的电子亲合能。因此,非金属元素的原子比金属元素的原子容易得电子。
【说明】
1. 电子亲和势的常用符号恰好同热力学惯用符号相反。热力学上把放出能量取为负值,例如,氟原子F(g) +e-→F-(g), ΔH= - 322kJ/mol。而氟的电子亲和势(EA)被定义为 322kJ/mol。为此,有人建议元素的电子亲和势是指从它的气态阴离子分离出一个电子所吸收的能量。于是,氟离子F-(g) -e-→F(g), ΔH= 322 kJ/mol。两者所用符号就趋于统一。可以认为,原子的电子亲和势在数值上跟它的阴离子的电离能相同。
2. 根据电子亲和势数据可以判断原子得失电子的难易。非金属元素一般具有较大的电子亲合势,它比金属元素容易得到电子。
3. 电子亲和势由实验测定,但目前还不能精确地测得大多数 元素的电子亲和势。
4. 元素的电子亲和势变化的一般规律是:在同一周期中,随着原子序数的增大,元素的电子亲和势一般趋于增大,即原子结合电子的倾向增强,或它的阴离子失去电子的能力减弱。在同一族中,元素的电子亲合势没有明显的变化规律。当元素原子的电子排布呈现稳定的s2、p3、p6构型时,EA值趋于减小,甚至ⅡA族和零族元素的EA都是负值,这表明它们结合电子十分困难。
5. 在常见氧化物和硫化物中含有一2价阴离子。从0-(g) 或S-(g)结合第二个电子而变成02-(g)或S2-(g)时,要受到明显的斥力,所以这类变化是吸热的。即0-(g) +e- → 02-(g),ΔH= 780kJ/mol;S-(g) +e- → S2-(g),ΔH= 590kJ/mol;这些能量能从形成氧化物或硫化物晶体时放出的晶格能得到补偿。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。