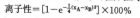电负性
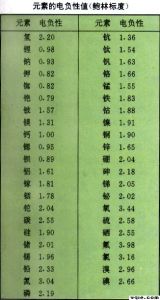
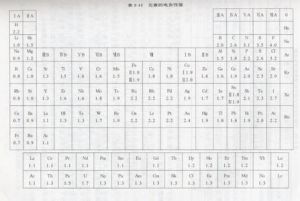
【电负性】 分子中原子对成键电子吸引能力的相对大小的量度。目前有三套电负性数据:鲍林(Linus Pauling)电负性,用xp表示;密立根(Mulliken)电负性,用xM表示;阿莱-罗周(Allred-Rochow)电负性,用xA表示。三套电负性数据,是在不同的基础上计算出来的,因此它们的数值不完全相同,但都能反映元素的原子在化合物中吸引电子的能力。
【说明】
1. 元素电负性的值是个相对的量,它没有单位。电负性大的元素吸引电子能力强,反之就弱。同周期主族元素电负性从左到右逐渐增大,同主族元素的电负性从上到下逐渐减小。
2. 元素电负性的概念最先是由鲍林(Linus Pauling, 1901— 1994)于1932年在研究化学键性质时提出来的。他指定电负性最大的氟的值为4. 0,然后根据键能推算其他元素的相对电负性的数值。后来又有人作了更精确的计算,对鲍林的电负性值作了修改。1934 年,马利肯(Robert. Sanderson Mulliken, 1896—)采用 电离能(I)和电子亲和势(EA)结合的方法求出电负。1957年, 阿莱-罗周(Allred-Rochow)又根据原子的有效核电荷(Z*)对成 键电子的静电引力算出一套电负性数据XAR。他们所用公式是 XAR=0. 359z*/r2 + 0. 744,式中r是原子的共价半径(10-10米)。
3. 现行中学课本上的元素电负性(XF=4.0, XCl = 3.0, XCs =0.7…)是鲍林最早的标度值。由于键能值已几经修改,现今书刊上的数据已不是原先的数据,已作适当的修正。
4. 元素的原子在不同分子中的价态、所带电荷量以及相应轨 道杂化方式等因素都会影响原子吸引电子的能力,因此每一元素的电负性实际表现不是一成不变的。
5. 根据元素电负性大小可判别化合物分子中键的性质。 两种元素的电负性差值(XA—XB)越大,形成键的极性越强。鲍林曾对A—B键的离子性大小提出如下经验方程式。
当键的离子性为50%时,相当于两元素电负性差值XA-XB =1.665。因此,习惯上就以电负性差值ΔX大于或小于1.7,作为判断该A—B键的离子性或共价性的依据。当ΔX>1.7时,多数属于离子键;当ΔX<1.7时,多数属于共价键。离子键和共价键没有严格的界限。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。