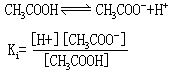电离平衡常数
【定义】弱电解质AB在水溶液里达成电离平衡后,溶液中电离出来的各种离子浓度的乘积([A+]×[B-] )跟溶液中未电离的分子浓度([AB])的比值,叫做该弱电解质的电离平衡常数,简称电离常数,用K电离表示。
【说明】
1. 电离平衡常数只随温度的变化而改变,不随参与电离平衡的分子和各离子的浓度变化而变化。K电离表达式中的各浓度指平衡时的浓度。
2.通常都用在25℃的电离常数来讨论室温下各种弱电解质溶液的平衡状态。
3.多元弱酸是分步电离的,它的每一步电离都有相应的电离常数,通常用K1、K2、K3等表示。它们的关系是K1>K2>K3,一般都要相差104-105倍。
4.硫酸是强电解质,但它在水溶液中是分级电离的。它的K2=1.20×10-2,这是因为一级电离产生的H+因同离子效应而抑制二级电离,使平衡向重新结合成HS04-方向移动,所以二级电离产生的H+浓度不大。
5.弱电解质在水溶液中存在电离平衡,跟化学平衡一样也可得到电离平衡常数,用Ki表示(弱酸的电离常数用Ka表示、弱碱的电离常数用Kb表示)。例如醋酸的电离平衡:
Ki的值与温度有关,而与浓度无关。一定温度下某弱电解质的Ki是定值,Ki越大表示电离程度越大。对同类型的弱酸或弱碱,比较其Ka或Kb值的大小,就可确定它们的相对强弱。如氢氟酸(HF)和氢氰酸(HCN)都是一元酸,前者电离常数Ka=6.5×10-4、后者的电离常数Ka=4.93×10-10,可知氢氟酸比氢氰酸强。