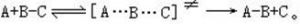过渡态理论
【过渡状态理论】也是一种有关反应速度的理论,是在统计力学和量子力学的发展中建立起来的。该理论的大意是:由反应物到产物必须经过一种过渡状态,即具有足够能量的反应物分子形成活化络合物的中间状态,反应物和活化络合物之间很快达到平衡,化学反应的速度由活化络合物的分解速度来决定。例如A原子和BC分子间的简单反应:
当A原子沿B—C轴线逐渐接近BC分子时,B—C间的化学键逐渐松弛,同时开始逐渐形成新的A—B键,在此过程中体系的位能增加,当形成过渡状态的活化络合物[A…B…C]≠ 时,体系的位能最高,活化络合物很不稳定,它可能分解变为产物,也可能重新变回反应物。由反应物变成活化络合物及由活化络合物变回反应物的速度都很快,在瞬间就能达到平衡,而由活化络合物分解变成产物的速度却是比较慢的,因此化学反应的速度取决于活化络合物分解的速度。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。