分配定律
【定义】一种物质在两种互不相溶的液相中都能溶解,当建立平衡后,该物质在两种液相中的浓度比是常数,这就是分配定律。 该常数叫做分配系数。
【说明】
1. 分配系数K实际上是物质在各相中建立平衡后的平衡常数。例如碘在水和二硫化碳中的分配:
I2(在H2O相中)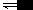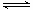 I2(在CS2相中)
I2(在CS2相中)
碘在该体系中的平衡常数是
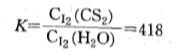
这个常数表示碘在二硫化碳和水的混合系中达到平衡时,碘在 二硫化碳相中的浓度是水相中的418倍。把二硫化碳加到碘水中,充分振荡后,绝大部分碘会转移到二硫化碳相中去。这种操作叫萃取。
2. 在文献手册中有时难以找到物质在不同溶剂中分配系数的数据。我们可以通过溶解度求算分配系数:一种物质分配在不同溶剂中的浓度比等于该物质在两种溶剂中的溶解度之比。
K=C1/C2=S1/S2
使用上述公式计算K时,被分配的物质在两个相中存在的形式必须相同才是准确的。
2. 在文献手册中有时难以找到物质在不同溶剂中分配系数的数据。我们可以通过溶解度求算分配系数:一种物质分配在不同溶剂中的浓度比等于该物质在两种溶剂中的溶解度之比。
K=C1/C2=S1/S2
使用上述公式计算K时,被分配的物质在两个相中存在的形式必须相同才是准确的。
3.应用分配定律的操作是萃取,它是富集和分离物质的重要手段,在化学分析、提纯和化工生产中有广泛的应用。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
