苯
【苯的结构】
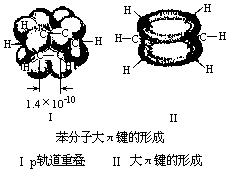
苯分子具有平面的正六边形结构。各个键角都是120°,六角环上碳碳之间的键长都是1.40×10-10米。它既不同于一般的单键(C—C键键长是1.54×10-10米),也不同于一般的双键(C=C键键长是1.33×10-10米)。从苯跟高锰酸钾溶液和溴水都不起反应这一事实和测定的碳碳间键长的实验数据来看,充分说明苯环上碳碳间的键应是一种介于单键和双键之间的独特的键。
为了表示苯分子结构的这一特点,常用下式来表示苯的结构简式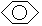 。直到现在,凯库勒式的表示方法仍被沿用,但在理解上绝不应认为苯是单、双键交替组成的环状结构。
。直到现在,凯库勒式的表示方法仍被沿用,但在理解上绝不应认为苯是单、双键交替组成的环状结构。
苯分子里6个碳原子的电子都以sp2杂化轨道相互重叠,形成6个碳碳的σ键,又各以1个sp2杂化轨道分别跟氢原子的1s轨道进行重叠,形成6个碳氢的σ键。由于是sp2杂化,所以键角是120°,并且所有6个碳原子和6个氢原子都是在同一个平面上相互连接起来的。
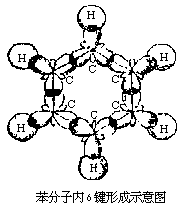
苯环上6个碳原子各有1个未参加杂化的2p轨道,它们垂直于环的平面,并从侧面相互重叠而形成一个闭合的π键,并且均匀地对称分布在环平面的上方和下方。通常把苯的这种键型称为大π键。苯的大π键的形成使π键电子云为6个碳原子所共有,因而受到6个碳原子核的共同吸引,彼此结合得比较牢固。同时,苯的大π键是平均分布在6个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的。
【苯的物理性质】
苯在常温下为无色透明液体。密度(15℃)0.885克/厘米3,沸点80.10℃,熔点5.53℃,易挥发,有强烈芳香气味。有毒。难溶于水,易溶于乙醇、乙醚等有机溶剂。
【苯的化学性质】
苯的化学性质较稳定,对酸性KMnO4溶液和溴水均无反应。易燃,燃时有浓黑烟。苯的化学反应可分为三大类:取代反应,如硝化反应和磺化反应;加成反应,如在镍为催化剂作用下,苯跟H2反应生成环己烷;苯环破裂反应,如苯在V2O5催化剂作用和加热条件下,用空气氧化生成顺丁烯二酸酐:
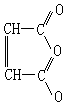
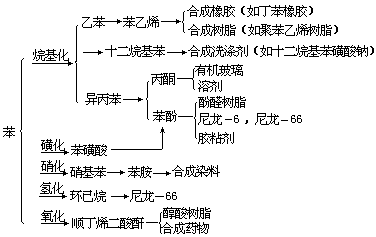
通过这些反应,可由苯制成多种重要的化学中间体,它们是合成橡胶、塑料、纤维、洗涤剂、染料、医药、农药、炸药等的重要基础原料。
【苯的用途】
过去,苯的主要用途是作汽油的掺合物,以提高汽油的辛烷值。随着石油化学工业的发展,作为化工原料的苯的用量越来越大,其中制苯乙烯、环己烷和异丙苯所耗用的量最多,约占世界总产量的80%。我国70年代纯苯的产量为16.67万吨,1983年达42.5万吨。苯的主要用途见下表:
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
