硝酸
【硝酸】无色液体,密度1.5027克/厘米3,熔点—42℃,沸点83℃,不断挥发出的蒸气有毒性和腐蚀性气味,易溶于水,属于挥发酸。常用者为68%溶液,无色,密度1.41克/厘米3,约相当于15摩/升。沸点120.5℃。93%HNO3因溶入NO2而呈黄至棕黄色,开盖则逸出棕色浓雾,叫发烟硝酸。应密闭保存于棕色玻璃塞瓶中,不可用无色试剂瓶和橡皮塞,以防见光分解,挥发和腐蚀橡皮。
HNO3具强酸性,强氧化性,浓硝酸能与除Au、Pt、Ta、Rh、Ir等很不活动金属外的所有金属反应。与冷浓HNO3呈钝态的金属有Fe、Al、Cr;生成可溶性硝酸盐与NO2。(有时杂有NO)的有Cu、Ag、Hg等;生成含氧酸或氧化物的有Sn、Sb、W、Mo等。对非金属可把C、S、P氧化为CO、H2SO4、H3PO4。稀硝酸氧化性比浓硝酸弱。因浓度不同还原产物可出现NO、N2O、铵盐等。个别杂有H2。实际上还原产物是不单一的,只是以某种为主,如6~8摩/升HNO3还原产物以NO为主。
硝酸不能与HI、H2S、HBr、Fe2+、SO2、亚硫酸盐等有明显还原性物质共存,因条件不同可将它们氧化为I2或HIO3、S或H2SO4、Br2、Fe 3+ 、H2SO4、硫酸盐等。
在光、热条件下分解,也能与木屑、碎布等可燃性有机物反应甚至燃烧,或自燃。保存时应使用棕色玻璃寒瓶,远离火源和叮燃有机物。浓硝酸与浓盐酸以体积比1:3混合而成“王水”能溶解Au、Pt等,王水不稳定,要现用现配。
历史上曾用智利硝石与浓硫酸共热制取。现改用氨氧化法制取,其法以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于800℃进行氧化反应,生成的NO在冷却时与O2生NO2,NO2在吸收塔内用水吸收在过量空气中O2的作用下转化为硝酸,最高浓度可达50%。制浓硝酸则把50%HNO3与Mg(NO3)2或浓H2SO4蒸馏而得。主要生产阶段的反应为:
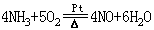
4NO+2O2 4NO2
4NO2
4NO2+O2+2H2O 4HNO3(即有O2时,计算时关系式为NH3~HNO3。)
4HNO3(即有O2时,计算时关系式为NH3~HNO3。)
硝酸厂尾气中氮的氧化物>0.4%(体积)需用碱液吸收制成NaNO2:NO+NO2+NaOH NaNO2+H2O,否则,严重污染大气。
NaNO2+H2O,否则,严重污染大气。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
