氟化氢
【概述】化学式HF,式量20.01。无色有刺激臭味气体或液体,极性分子,由于很强的氢键作用,常温下气体呈(HF)n(n=2~6)的缔合形式存在,80℃以上才基本由HF组成。液态时可能以比较稳定的五分子环(HF)5或六分子环(HF)6状态存在。气体密度0.991克/升,液体密度0.987克/厘米3,沸点19.54℃,熔点-83.1℃,有很强的腐蚀性和毒性。在空气中易形成白色酸雾,易溶于水,水溶液叫氢氟酸,酸性较弱。能溶于乙醇。能腐蚀玻璃。氟化氢是一个介电常数大的液体,能自行电离,并能与许多溶质形成导电溶液,可溶解许多有机化合物。无水液态氟化氢是一种很强的酸。应保存在塑料容器中。用于制氟化物、氢氟酸、氟硼酸、氟硅酸、有机氟碳化合物,含氟冷冻剂、含氟树脂,还用作半导体材料的清洗剂,蚀刻玻璃等。用浓硫酸跟氟化钙反应制得。
【结构】
氟化氢是极性分子,在293K时能无限制地溶于水中,原因是它同水形成氢键。氟化氢的水溶液称为氢氟酸。
氟化氢的熔点、沸点和气化热特别高是因为其分子间存在氢键的缘故。实验证明,氟化氢在气态、液态和固态时都通过氢键形成不同程度的缔合。在360K以上它的蒸气密度相当于HF,在299K时相当于(HF)2和(HF)3的混合物。在固态时,氟化氢由无限长的锯齿形长链组成。
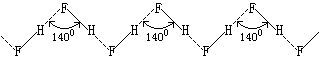
【性质】【氢氟酸】
氢氟酸是一弱酸(298K时,Ka=3.5×10-4 )。与其它弱酸相同,浓度越稀,HF电离度越大。但溶液浓度增大时,HF2- 离子增多。因为在氢氟酸溶液尤其是浓溶液中,一部分F- 离子通过氢键与未离解的HF分子形成缔合离子,如HF2- 、H2F3- 、H3F4- 等,其中HF2- 离子特别稳定。
HF + F- ![]() HF2- K=5.1
HF2- K=5.1
稀溶液: HF + H2O![]() H3O+ + F- Ka=3.5×10-4
H3O+ + F- Ka=3.5×10-4
浓溶液: 2HF + H2O![]() H3O+ + HF2-
H3O+ + HF2-
HF2- 离子是一弱碱,比水合F- 离子稳定,使上式平衡向右移动从而使氢氟酸的电高度增大。当浓度大干5mol·L-1 时,氢氟酸已经是相当强的酸。用碱中和氢氟酸溶液能生成酸式盐如KHF2也说明HF2- 离子的稳定性。
氢氟酸的另一个特殊性质是它能与二氧化硅或硅酸盐反应生成气态SiF4。
SiO2+4HF![]() SiF4+2H2O
SiF4+2H2O
CaSiO3+6HF![]() CaF2+SiF4+3H2O
CaF2+SiF4+3H2O
液态氟化氢有微弱的自偶电离:
2HF![]() H2F+ + F- K≈10-10
H2F+ + F- K≈10-10
它的介电常数(84)和水(81)相仿,是一种有用的溶剂,能溶解很多无机物和有机物。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
