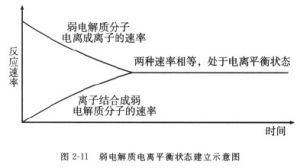
电离平衡
【定义】多数弱电解质为含有较弱极性键的共价化合物,溶解后,受到水分子的作用,只有部分分子发生电离;同时,电离出的阴阳离子在水中碰撞时,又能重新结合成分子。因此,弱电解质的电离是可逆的,在一定条件下,分子的电离和离子结合成分子的速度相等,称作电离平衡。
【说明】
1、在一般浓度下,弱电解质主要以分子形成存在于溶液中。注意,难溶的弱电解质溶于水的部分存在电离平衡,难溶的强电解质溶于水的部分全部电离,不存在电离平衡。影响电离平衡的因素除了溶质、溶剂的性质外,还有温度、浓度等外界条件。升温或加水稀释都能使电离平衡向正方向移动。
2、电离平衡跟其他化学平衡一样,也是动态平衡。到达平衡时,参与电离平衡的分子和各种离子的浓度都保持不变,但电离和重新结合都仍在进行。
3、这种平衡是有条件的,因而是暂时的、相对的。当条件改变时,原有的平衡将被破坏,逐渐向新条件下的平衡状态方向移动,最后达成新的平衡状态。例如,增大电解质分子的浓度,或减小相应离子的浓度,都会使平衡向电解质分子电离的方向移动; 反之,就会向离子重新结合成分子的方向移动。
4、电离一般伴随有热效应,所以改变温度会使电离平衡发生移动。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。