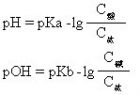缓冲溶液
【定义】能抵抗外加少量强酸、强碱或稀释的影响,而本身的pH值不发生显著变化的溶液。
【说明】
1、缓冲溶液有三种类型:弱酸及其盐(如HAc—NaAc)、弱碱及其盐(NH3·H2O—NH4Cl)、多元弱酸盐及其对应的次级盐(NaH2PO4—Na2HPO4),总之缓冲溶液由弱酸及其共轭碱或弱碱及其共轭酸组成。
2、缓冲溶液具有缓冲能力的原因,以HAc—NaAc混和溶液为例:
HAc 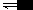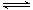 H+ + Ac-
H+ + Ac-
NaAc=Na+ + Ac-
当加入少量酸时,体系中Ac-与加入的H+结合成HAc分子,而体系中[H+]无明显增加,Ac-为体系中抗酸部分;当加入少量碱时,体系中的HAc能与之中和,体系中[OH-]亦无明显增加,HAc为体系中的抗碱部份。缓冲溶液的pH值(或pOH值)可按下式计算:
3、缓冲溶液的缓冲能力是有限的,一般说C酸(或C碱)和C盐的数值较大且浓度相近时能力最大,一般取C酸/C盐或C碱/C盐之值在0.1~10之间。缓冲溶液在工业、农业、医学、化学、生理学方面有重要用途,如土壤、人的血液中都有复杂的缓冲体系,从而保持一定的pH值,使植物正常生长,使人维持正常的生理活动。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。