电极电势
【定义】电极电势又称电极电位或电极势。它主要是由电极和电解质溶液跟电极接触处存在双电层而产生的平衡电势。它跟电极电势和电极种类、溶液中相应离子的浓度,以及温度、压强等因素有关。 它的大小决定电极上可能发生的反应。电极电势代数值小的电极上起氧化反应,是原电池的负极;代数值大的电极上起还原反应, 是正极。
【说明】
1、由于无法直接测定各单个电极的绝对电势的值,常用人为规定的标准来测定电极电势的相对值。1953年,国际纯粹与应用化学联合会(IUPAC)规定,在任意温度下标准氢电极的电极电势 ψφ (H2)=0,并以这种电极作为发生氧化作用的负极,以待定电极作为发生还原作用的正极,组成电池(Pt)H2(Pφ 丨H+ (α=l)|丨待定电极。以该电池电动势的值和符号,作为待定电极的电极电势的值和符号。
2、实际使用时,规定以25℃、101kPa下溶液中有关离子的有效浓度为lmol/L (或活度为1),且电极上参与电极反应的纯物质为最稳定的聚集态时,和标准氢电极之间的电势差就是该电极的标准电极电势。把各电极的标准电极电势排成一张表以便查阅。标准电极电位的数值越大(正值越大),说明该电对中的氧化态的氧化性越强,标准电极电位的数值越小(负数的绝对值越大),说明该电对中的还原态还原性越强。
3、元素的标准电极电势通用两种表示方法。例如,半反应为 Cl2+ 2e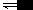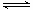 2Cl- 的电对是C12/C1- ,它的电极电势可表示为
2Cl- 的电对是C12/C1- ,它的电极电势可表示为
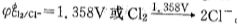
。后面一种表示方法还可以连续地表示同一元素组成的各种电对,组成该元素的标准电极电势图。例如,
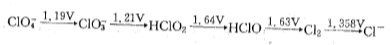
ψφ 值越大,表示电对中氧化型物质得电子的能力越强,还原型物质失电子能力越弱。标准电极电位有广泛的应用,例如可以判断氧化—还原反应的方向和程度,可以求算水溶液中发生的氧化还原反应的化学平衡常数,可以求算难溶盐的溶度积等。
4、电极电势跟浓度的关系可以用能斯特方程式定量表示。

附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
