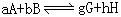
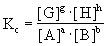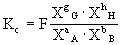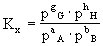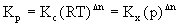化学平衡常数
【定义】系在一定温度下,可逆反应达到化学平衡状态时,生成物浓度的反应系数次幂的乘积与反应物浓度的反应系数次幂的乘积之比值,这个比值在一定温度下是个定值。
用浓度表示的平衡常数为:
式中[A]、[B]、[C]、[D]代表平衡体系中各组分的浓度。
也可用各组分的摩尔分数计算平衡常数,以Kx表示(X代表组分的摩尔分数):
对于有气体参加和生成的反应,也可用各组分的分压计算平衡常数,以Kp表示:
以上三种平衡常数可以进行如下换算:
式中R为气体常数、T为绝对温度、p为体系总压、△n=(g+h)-(a+b)。
【说明】
1. 表达式中各物质的浓度必须是平衡状态下的值,不能用任一时刻的浓度值。所以平衡常数Kc不随反应物或生成物浓度而变,但随温度的改变而政变。
2. 有气体参加的反应,可用气体分压的指数幂表示,写成Kp
3. 有固体物质参加的反应,固体浓度可以不写,因为分子间碰撞只能发生在固体表面,固体浓度可视为常数。稀溶液中的水分子浓度也可以不写。因为水的摩尔浓度是1000/18 = 55.5mol/L (稀溶液的密度近似等于1g/cm3),也是一个常数。
4. 化学平衡常数表达式跟反应方程式的书写形式有关。
5. 平衡常数K值的大小,表明反应进行的程度。K值越大,表示平衡时生成物浓度对反应物浓度的比越大,即反应进行得越完全,反应物的转化率越高。
6. 使用催化剂能改变化学反应速率,但不会使平衡移动,因此不会改变平衡常数。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。